
Хімічне окислення хлоруванням або дозуванням розчину перекису водню — найбільш потужний метод очищення води від вмісту сірководню. Дозування розчину гіпохлориту натрію або перекису водню здатне забезпечити видалення сірководню у дуже високих концентраціях від 6 до 75 мг/л в межах рН від 6 до 8 ( для Н2О2 — в межах рН 4-9). Хлор або перекис водню швидко окислює сульфід (S2-), бісульфід-аніон (HS—) і сірководень (H2S), створюючи окисні сполуки, які не впливають на смак і запах води. Нерозчинна елементарна сірка (як кінцевий продукт окислення сірководню) здатна фарбувати сантехнічні поверхні в жовтий колір і вилучається із води за допомогою фільтра тонкого очищення. Найкращий варіант фільтрувального середовища – каталітичне гранульоване активоване вугілля, яке також здатне видаляти залишковий хлор, перекис водню і органічні сполуки. Перекис водню на відміну від хлора не придає воді специфічний запах і присмак та вважається окисником преміум-класа на рівні з озоном.
Часто сірководень зустрічається в природній підземній воді в ассоціації з залізом та марганцем. Дозування окисника (гіпохлориту натрія або перекису водню) з наступною фільтрацією продуктів окислення – найбільш рекомендований (професійний) метод видалення сірководню разом з залізом та марганцем в сукупній концентрації до 10 мг/л. Хлор або перекис водню окислює залізо і марганець до нерозчинних форм, які в подальшому відфільтровуються в фільтрі з протиточним способом промивання. Протиточне промивання гранульованого фільтрувального завантаження від затриманих продуктів окислення здійснюють один раз на кілька днів або, в окремих випадках, навіть тижнів. Ключові фактори ефективної роботи таких систем – достатня концентрація окисника і час контакту.
Хлор або розчин гіпохлориту натрія.
1 мг/л H2S – хлор 2,2 мг/л або розчина (5,25%) гіпохлориту натрія з розрахунку 33,4 мг на кожні 375 літрів води.
1 мг/л Fe – хлор 0,64 мг/л або розчина (5,25%) гіпохлориту натрія з розрахунку 9,7 мг на кожні 375 літрів води.
1 мг/л Mn – хлор 1,3 мг/л або розчина (5,25%) гіпохлориту натрія з розрахунку 19,7 мг на кожні 375 літрів води.
Реакція окислення сірководню гіпохлоритом натрію.
![]()
Перекис водню H2O2.
1 мг/л H2S – перекис водню 2,5 мг/л.
1 мг/л Fe – перекис водню 1 мг/л.
1 мг/л Mn – перекис водню 1,8 мг/л.
Видалення сірководню хімічним окисленням перекисом водню максимально ефективне та швидке в присутності каталізатора — наприклад, метала змінної валентності, такого як залізо або марганець.
Реакції окислення сірководню та сульфідів в воді з кислотним, нейтральним та лужним середовищем.
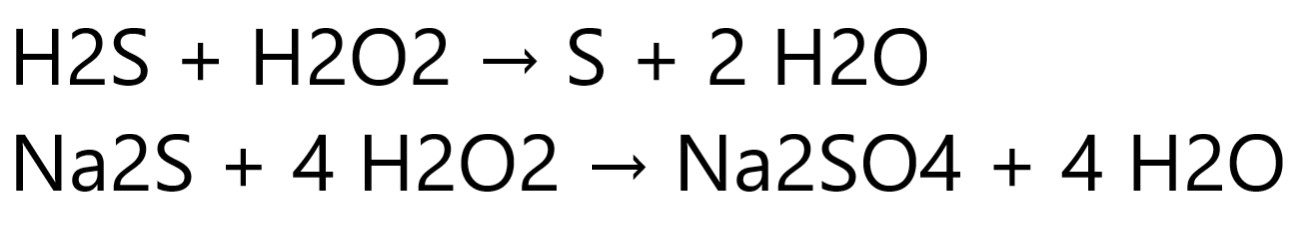
Час контакту залежить від типу забруднення, температури води і рН. Тоді як окислення заліза і сірководню відбувається миттєво, окислення марганцю відбувається досить повільно. Крім окисної дії хлор та перекис водню здатні знезаражувати воду, зокрема вбивати залізобактерії, сіркобактерії та інші шкідливі мікроорганізми. Знезараження води потребує не менше 20 хвилин експозиції, що, відповідно, потребує наявності контактної емності достанього об’єму. Зокрема залізобактерії, створюючи бактеріальний шлам з ліпополісахаридів та окису заліза, здатні в короткий час повністю вивести з ладу фільтр знезалізнення або систему пом’ягшення. Хлор або перекис водню ліквідують проблему бактеріального зараження.
Серед основних недоліків систем дозування окисника з подальшою фільтрацією – складність хімічних процесів, відносна складність системи і, відповідно, ціна комплекту обладнання, напівавтоматичне функціонування систем, яке потребує обслуговування, зокрема контролю за подачею реагента і додавання реагента.
