Главная > Статьи > Страница12
Комбінація у водопідготовці окислювачів «преміум-класу» – озонe O3 та перекису водню H2O2. Покращий процес глибокого окислення та дезінфекції, що характеризується утворенням гідроксильних радикалів. (НО•). Гідроксильні радикали атакують домішки, стійкі до окислювального впливу озону.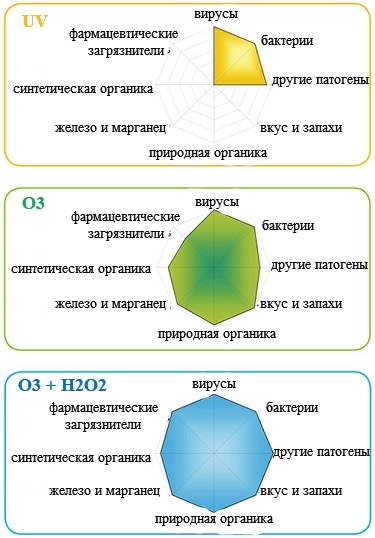 У присутності у воді перекису водню (H2O2), озон (O3) реагує з аніоном перекису водню (HO2–) з утворенням надзвичайно хімічно агресивного гідроксильного радикалу (НО•), що має властивості потужного окислювача. Гідроксильний радикал реагує у воді з більшістю органічних сполук, кардинально руйнуючи все, що тільки може бути окислене. Утворення радикалу гідроксилу проходить значно швидше та ефективніше, ніж при прямій реакції озону з водою. З хімічними речовинами у воді озон реагує, задіявши два різні механізми:
У присутності у воді перекису водню (H2O2), озон (O3) реагує з аніоном перекису водню (HO2–) з утворенням надзвичайно хімічно агресивного гідроксильного радикалу (НО•), що має властивості потужного окислювача. Гідроксильний радикал реагує у воді з більшістю органічних сполук, кардинально руйнуючи все, що тільки може бути окислене. Утворення радикалу гідроксилу проходить значно швидше та ефективніше, ніж при прямій реакції озону з водою. З хімічними речовинами у воді озон реагує, задіявши два різні механізми:
– безпосередньо як молекулярний озон (повільно і вибірково);
– як гідроксил-радикал (швидко і не вибірково), що отримується в процесі розпаду озону у воді.
Прийнято вважати, що у нейтральній воді з рН=7 обидва ці механізми дії рівноцінні. У воді з кислою реакцією (рН<7) переважає молекулярний механізм, у воді з лужною реакцією (рН>7) – радикальний механізм. Комбінування озону з перекисом водню – найбільш доступний спосіб індукції окислювальних процесів у воді із залученням другого механізму. Взаємодія перекису водню та озону – процес, швидкість якого залежить від рН. Зі зростанням рН зростає швидкість реакції. Порівняння окислювальних потенціалів.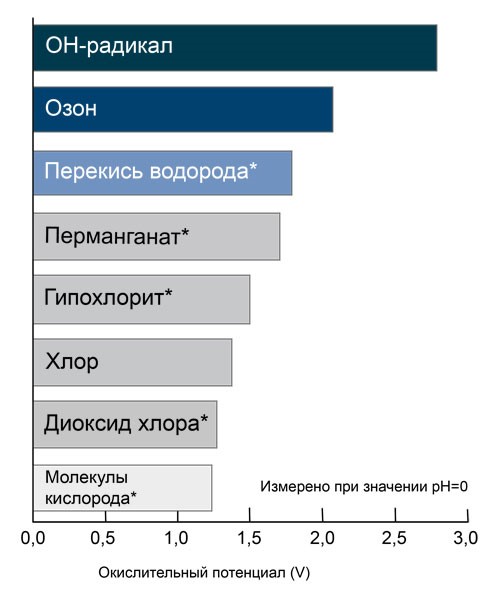 Реакції озону з молекулами води та гідроксид-іонами.
Реакції озону з молекулами води та гідроксид-іонами.
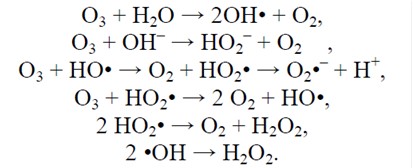
Реакції озону із водою у загальному вигляді. Всі перехідні процеси, незалежно від їх відносної швидкості, закінчуються кінцевими продуктами реакцій – водою та киснем.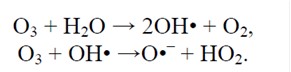 Основні переваги застосування озону у водопідготовці наступні: – сильний дезінфектор з потужною антивірусною дією та один з найсильніших окислювачів, що поступається за окислювальною здатністю лише нестабільному гідроксил-радикалу та стабільній речовині – фтору;
Основні переваги застосування озону у водопідготовці наступні: – сильний дезінфектор з потужною антивірусною дією та один з найсильніших окислювачів, що поступається за окислювальною здатністю лише нестабільному гідроксил-радикалу та стабільній речовині – фтору;
– на відміну від хлору (активного галогену) не створює побічні продукти окислення органіки – тригалометани.
Основні обмеження застосування озону у водопідготовці наступні:
– має короткочасну дію;
– маючи потужну окислювальну дію озон трансформує складні органічні сполуки в прості сполуки, що передбачає обов’язкову наявність комплексу заходів щодо вилучення з води продуктів дезінфекції та окислення. Продукти дезінфекції та окислення органіки з високим ступенем біодеградації створюють умови для розвитку повторного бактеріального забруднення, включаючи патогенні бактерії;
– якщо озон використовується для дезінфекції води у великих дозах, окислення озоном органічних сполук здатне утворювати інші токсичні продукти окислення – кетони, бромати, карбонові та сульфонові кислоти, феноли та альдегіди (формальдегід, який необхідно контролювати у воді). Основний недолік озонування – короткочасна дія (такий недолік відсутня у хлорування).
Озон – речовина з високою швидкістю розкладання у воді. Також, якщо оброблена вода має високу кольоровість або підвищений вміст органічних сполук, озонування призведе до утворення продуктів окислення, для фільтрації яких необхідне застосування активованого вугілля. Окремі хімічні речовини мають стійкість до озону (наприклад, пестициди, речовини промислової хімії та продукти фармакології – атразин, ібупрофен, 1,4-діоксан, метит-трет-бутиловий ефір (MTBE), диметилнітрозамін (NDMA)). У таких випадках застосовують покращену технологію “глибокого окиснення” – озонування води комбінують із дозуванням перекису водню.

