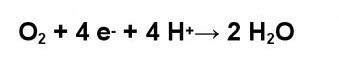Активні форми кисню. Пероксид водню та гідроксильний радикал. Katalox Light.
Активні форми кисню.
Звичайні молекули містять на зовнішній орбіталі електронної оболонки два спарені електрони. Взаємодія магнітних моментів цих електронів забезпечує молекулі хімічну стабільність. Радикал характеризує наявність на зовнішній орбіталі одиночного (неспареного) електрона, що зумовлює виняткову хімічну активність частки, що прагне повернути ще один електрон у зовнішню орбіталь у процесі взаємодії з іншими частинками. Фактично молекула триплетного кисню О2, володіючи двома непарними електронами у двох молекулярних орбіталях, також є бі-радикал, що пояснює його підвищену хімічну активність.

Одноелектронне відновлення молекулярного кисню перетворює молекулу на негативно заряджений радикал з одним неспареним електроном у зовнішній орбіталі – на супероксид-аніон О2•-. Супероксид має одночасно як властивості окислювача, так і властивості відновлювача, що виявляються залежно від молекули речовини, з якою супероксид взаємодіє. Якщо така молекула відсутня аніон супероксиду реагує з іншою молекулою супероксиду, приєднуючи протон (H+) і утворюючи нейтральний радикал гідропероксиду OOH•, що не має заряду. При одноелектронному відновленні радикал гідропероксиду трансформується на аніон пероксиду водню (HOO–) – молекулу з негативним зарядом. Аніон пероксиду водню, приєднавши протон (H+), утворює чергову нейтральну, найбільш стабільну з усіх форм активного кисню, молекулу пероксиду водню H2O2.
Пероксид водню та радикал гідроксилу.
При взаємодії молекули пероксиду водню з металами змінної валентності (наприклад, марганцем Mn4+ або залізом Fe2+) відбувається розпад H2O2 на воду та кисень з проміжним утворенням аніону гідроксилу (ОН–) та радикалу гідроксилу (ОH•), що володіє винятковою хімічною активністю та окислювальною потужністю. Всі перелічені вище радикали, іони і молекули є активними формами кисню*.
Фільтруюче середовище Katalox Light, пероксид водню та гідроксил-радикал.
Пероксид водню – потужніший окислювач порівняно з хлором чи діоксидом хлору. Фільтруюче середовище Katalox Light, що використовується у водопідготовці, являє собою гранули цеоліту, вкриті щільним шаром гамма-діоксиду марганцю. Гамма-діоксид марганцю – каталізатор розпаду пероксиду водню H2O2 на воду та кисень з проміжним утворенням аніон гідроксил-аніону (ОН–) та виключно хімічно агресивного гідроксилу-радикалу (ОH•), окислювальна здатність якого поступається тільки фтору
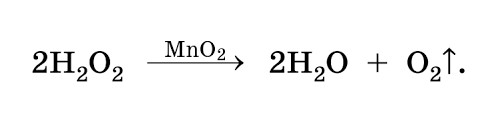
Фільтруюче середовище Katalox Light у поєднанні з пероксидом водню, крім традиційного окислення та видалення заліза, марганцю та сірководню, руйнує у воді залишковий хлор, хлораміни, природні та синтетичні органічні речовини, тіосульфати, сульфати та сульфіди, забезпечує контроль легіонелл, сірко- та залізо- бактерій.
*Активні форми кисню (АТФ) – продукти неповного відновлення кисню. Крім перерахованих вище радикалів, іонів і молекул АТФ також включають озон і синглетний кисень – сполуки кисню, які не мають електронного спину (не радикали). Відновлення молекулярного кисню до води вимагає поетапного приєднання 4-х електронів та 4-х протонів. Усі проміжні продукти приєднання електронів та протонів – короткоживучі активні форми кисню.