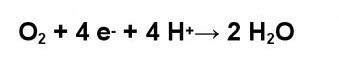Главная > Статьи > Страница10
Активные формы кислорода. Пероксид водорода и гидроксильный радикал. Katalox Light.
Активные формы кислорода.
Обычные молекулы содержат на внешней орбитали электронной оболочки два спаренных электрона. Взаимодействие магнитных моментов этих электронов обеспечивает молекуле химическую стабильность. Радикал характеризует наличие на внешней орбитали одиночного (неспаренного) электрона, что обуславливает исключительную химическую активность частицы, стремящейся вернуть себе еще один электрон во внешнюю орбиталь в процессе взаимодействия с другими частицами. Фактически молекула триплетного кислорода О2, обладая двумя непарными электронами в двух молекулярных орбиталях, также представляет собой би-радикал, что объясняет его повышенную химическую активность.

Одноэлектронное восстановление молекулярного кислорода превращает молекулу в отрицательно заряженный радикал с одним неспаренным электроном во внешней орбитали – в супероксид-анион О2•-. Супероксид обладает одновременно как свойствами окислителя, так и свойствами восстановителя, проявляемыми в зависимости от молекулы вещества, с которой супероксид взаимодействует. Если такая молекула отсутствует анион супероксида реагирует с другой молекулой супероксида, присоединяя протон (H+) и образуя нейтральный радикал гидропероксида OOH•, не имеющий заряда. При одноэлектронном восстановлении радикал гидропероксида трансформируется в анион пероксида водорода (HOO—) – молекулу с отрицательным зарядом. Анион пероксида водорода, присоединив протон (H+), образует в свою очередь нейтральную, наиболее стабильную из всех форм активного кислорода, молекулу пероксида водорода H2O2.
Пероксид водорода и радикал гидроксила.
При взаимодействии молекулы пероксида водорода с металлами переменной валентности (например, марганцем Mn4+ или железом Fe2+) происходит распад H2O2 на воду и кислород с промежуточным образованием аниона гидроксила (ОН—) и радикала гидроксила (ОH•), обладающего исключительной химической активностью и окислительной способностью. Все перечисленные выше радикалы, ионы и молекулы представляют собой активные формы кислорода*.
Фильтрующая среда Katalox Light, пероксид водорода и гидроксил-радикал.
Пероксид водорода – более мощный окислитель в сравнении с хлором или диоксидом хлора. Фильтрующая среда Katalox Light, используемая в водоподготовке, представляет собой гранулы цеолита, покрытые плотным слоем гамма-диоксида марганца. Гамма-диоксид марганца – катализатор распада пероксида водорода H2O2 на воду и кислород с промежуточным образованием анион гидроксил-аниона (ОН—) и исключительно химически агрессивного гидроксил-радикала (ОH•), окислительная способность которого уступает только фтору.
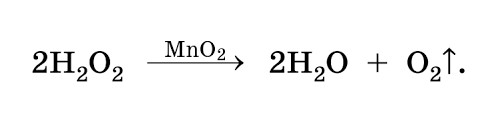
Фильтрующая среда Katalox Light в сочетании с пероксидом водорода, кроме традиционного окисления и удаления железа, марганца и сероводорода, разрушает в воде остаточный хлор, хлорамины, природные и синтетические органические вещества, тиосульфаты, сульфаты и сульфиды, обеспечивает контроль легионелл, серо- и железо- бактерий.
*Активные формы кислорода (АТФ) – продукты неполного восстановления кислорода. В дополнение к перечисленным выше радикалам, ионам и молекулам АТФ также включают озон и синглетный кислород — соединения кислорода, не обладающие электронным спином (не радикалы). Восстановление молекулярного кислорода до воды требует поэтапного присоединения 4-х электронов и 4-х протонов. Все промежуточные продукты присоединения электронов и протонов – короткоживущие активные формы кислорода.