Безнапорная аэрация создает предпосылки для удаления железа из анаэробной воды скважины в концентрациях до 10 мг/л в наиболее экономичный способ.
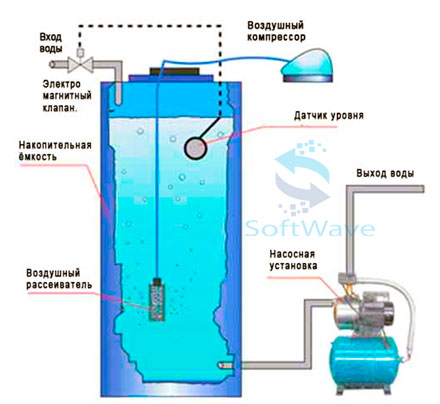
Форсунки распыляют воду в воздухе в открытую контактную емкость. Контакт воды с атмосферным воздухом нарушает исходное равновесие анаэробной подземной воды и приводит к формированию нового равновесного состояния. Углекислота и сероводород теряют растворимость и покидают воду, вода поглощает атмосферный кислород. Разность парциальных давлений на границе раздела фаз определяет скорость и направление диффузии газов. Все массообменные процессы — в точном соответствии с законом Генри-Дальтона. С потерей углекислоты и сероводорода растет показатель рН. Насыщение воды кислородом обуславливает рост окислительного потенциала среды. Увеличение водородного показателя приводит к дестабилизации соединений двухвалентного железа. Кислород окисляет железо. Скорость окисления двухвалентного железа определяется водородным показателем – увеличение рН на 1 единицу увеличивает скорость окисления приблизительно в 100 раз!
Железо стремится достичь наивысшей формы валентности, обрести термодинамически устойчивое состояние, окислившись до конечного продукта – гидроокиси железа.
Дело останется за малым — удалить нерастворимые хлопья гидроокиси фильтрацией воды в напорном фильтре.
Теперь подробнее, с акцентом на отдельных аспектах!
Вода может содержать железо в двух формах окисления (Fe2+, Fe3+), в составе комплексных соединений или в свободном состоянии.
Скважинная вода содержит преимущественно растворенное железо в двухвалентной форме и другие металлы в низкой степени валентности, не содержит кислород, содержит углекислоту и сероводород, обладает, как правило, слабокислой реакцией (низким рН), и представляет собой восстановительную среду (окислительно-восстановительный потенциал Еh<0). Следовательно, действие установок обезжелезивания должно быть сосредоточено на удалении именно такой двухвалентной формы железа в воде с перечисленными характеристиками и свойствами.
Кислород, время контакта и площадь поверхности контакта!
Безнапорная аэрация предполагает использование в качестве окислителя кислород из атмосферного воздуха. Низкий окислительный потенциал кислорода обуславливает необходимость большого времени экспозиции – времени на диффузию кислорода и стабилизацию состояния окисленных форм. Больше железа – больше время экспозиции. Вода с концентрацией железа 5 мг/л потребует для окисления экспозиции не менее 15-20 минут. Кроме концентрации железа время окисления будет прямо определяться площадью поверхности контакта воды и воздуха.
Взаимодействие в открытой контактной емкости 1 кубического метра воды с воздухом только через зеркало воды обеспечит контактную площадь поверхности раздела фаз 0,5- 2м2. Этой площади контакта не достаточно.
Распыление 1 кубического метра воды через аэрационные форсунки в воздушном пространстве открытой контактной емкости в безнапорном варианте аэрации обеспечит поверхность контакта уже около 40-70 м2. Это уже лучше.
Наличие воздушного компрессора и эффективный барботаж в контактной емкости позволит увеличить площадь поверхности контакта до 80-150 м2.
Применение статического миксера, заполненного кольцами Рашига или насадками Палля, сможет обеспечить поверхность раздела фаз для кубического метра воды площадью около 400-500м2. Все результаты познаются в сравнении.
Окислительный потенциал кислорода! Атмосферный кислород или озон!
Из всех традиционных окислителей, применяемых в водоподготовке, атмосферный кислород О2 обладает самым низким окислительным потенциалом (+0,41В), озон О3– самым высоким потенциалом (+2,07В).
Озон обладает наибольшей «окислительной силой» и реагирует фактически с любым веществом, способным окисляться. Кислород такой силой не обладает. Кислород не окисляет все способные к окислению вещества. Кислород окисляет вещества избирательно. Кислород не обеспечивает дезинфекцию воды. Слабый окислительный потенциал кислорода не позволяет окислить органическое железо.
Но кислород отлично окисляет двухвалентное железо и не создает нежелательные побочные продукты, присущие действию других, более сильных окислителей (хлора, озона). Не в слабых ли взаимодействиях кроется настоящая сила тонких природных процессов окисления и фильтрации воды в горных источниках? Кислород остается слабым, но при этом единственным по настоящему экологически чистым окислителем в водоподготовке. Чистым и бесплатным!
Конечно же, выбор окислителя должен учитывать формы железа в скважинной воде.

